超好熱始原菌 Thermococcus kodakaraensis
耐熱性プロテアーゼ
生育最適温度 90℃の超好熱菌 Pyrococcussp. KOD1(後にThermococcus kodakaraensis KOD1 と改称)を鹿児島県小宝島の硫気孔から分離し、原核生物としては珍しいチオールプロテアーゼ(反応最適温度 110℃)の特性を明らかにしました [10, 39, 75].(図1, 図2)
ごく最近、KOD1 が枯草菌由来セリンプロテアーゼ;サチライシンと類似(アミノ酸配列同一性 37.4% )のプロテアーゼも分泌生産していることを見出し、遺伝子クローニングおよび大腸菌での大量発現に成功しています。
本酵素の反応最適温度は 80- 85℃であり、枯草菌由来サチライシンと比較して 13-20 残基の荷電性ペプチド部分が分子表面に3ケ所挿入しているという構造上の特徴があります。
相同性組み換えタンパク質 RecA
全ての生物がその生命維持のために普遍的に保有している RecA タンパク質の祖先と推定されるタンパク質(Tk-REC/RadB)を KOD1 から遺伝子クローニングしました [14].
本酵素は RecA(細菌型)あるいは Rad51(真核生物型)の活性中心ドメインに相当する部分しか持たないにもかかわらず、大腸菌の RecA 欠損を完全に相補する活性があることが in vivo での実験により示されました。
さらに Tk-REC は、通常は別の酵素が担っている DNA 分解活性をも有しており、ATPase 活性による最終反応産物は ADP ではなく AMP であることも明らかにしています [15, 22, 43].
これらの結果は、現在に比べて紫外線が強く照射していた太古の地球環境下において、初期の生命が有していた仕組みを彷佛とさせます。
X線結晶解析法によりその立体構造を決定したところ、大腸菌 RecA と基本構造が極めて類似していることがわかりました [30, 71].
転写調節タンパク質
Archaea(始原菌)の転写開始機構は原核生物とは異なりむしろ真核生物のものと類似しています。
まず、一般転写因子である TATA-binding protein(Pk-TBP)を遺伝子クローニングし、等電点が 4.8 の強酸性タンパク質であることを見出しました [12].
そこで、Pk-TBP をリガンドとしたアフィニティーカラムを作製し KOD1 の細胞抽出液を分画したところ、真核生物には見られない分子量 26 kDa および 40 kDa のタンパク質が強くカラムに結合しました。
このうち 26 kDa タンパク質(Pk-TIP)の遺伝子全長をクローニングし大腸菌で大量発現させた後、Pk-TBP と共にプロモーター遺伝子 (TATA領域)との結合実験を行った結果、Pk-TBP の TATA 領域への結合を顕著に阻害しました。
すなわち、Pk-TIP は始原菌固有の負の転写調節因子であることが示唆されました [28, 42].
X線結晶構造解析によって、その機能構造が裏付けられました [58 73].
図1.超好熱始原菌をもとめて火山島へ
1991年に(株)海洋バイオテクノロジー研究所の協力により 実験船 蒼玄丸 で奄美諸島の島々を巡り、多数の試料の収集を行いました.
岩の下にある硫気吹溜りから熱水を採取し、密栓冷蔵保存の状態で研究室に持ち帰りました.
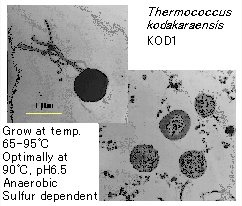
図2.新種の超好熱始原菌 Thermococcus kodakaraensis KOD1 株の電子顕微鏡観察
直径約1μmの不定形球菌.生育温度域は 65-95℃.鞭毛による運動性を有する.硫黄依存型の絶対嫌気性菌細胞外にプロテアーゼを分泌し、ペプチド性の栄養源を利用する従属栄養生物.