研究テーマ
―バイオフィルム(Biofilms)―
- バイオフィルムについての研究内容(このページ)
- バイオフィルム細胞に学ぶこと
"Learn from sessile cells" (別のページ) - バイオフィルムの研究で科研費を獲得しました.
『バイオフィルム形成分子機構を切り口とした微生物未知機能の解明』 [PDF (68 KB)]
これまで微生物の実験といえば、豊富な栄養条件下でフラスコ振盪培養あるいは通気撹拌培養を行い、そこで生育した浮遊状態の細胞を扱うことが当たり前でした. しかし、自然界において多くの微生物は浮遊状態よりもむしろ、固体表面に付着し独自の戦略を使いながら、それぞれの過酷な環境でしたたかに生存していることが最近になってわかってきました. 固体表面に接着した微生物が形成する高次構造体をバイオフィルム(biofilms)と呼びます. バイオフィルムを形成することによって微生物たちは好ましい環境に滞留し、スクラムを組むことによって様々な攻撃から身を守っているのです. バイオフィルム細胞は浮遊細胞とは異なる遺伝子群を発現していることが既に知られています. すなわち、これまでの方法では微生物本来の姿の一面を見落としてしまっている可能性があるのです.
バイオフィルムに関する分子生物学的研究は主として病原菌を対象として進められ、毒素生産調節や高度抗生物質耐性機構が解明されつつあります. 私たちは、様々な工業微生物群および特殊環境微生物群のバイオフィルム形成機構に関する研究を通して、微生物が持つ未知の生存戦略を明らかにしてゆきたいと考えています [解13, 著4,著6,著7, 75].
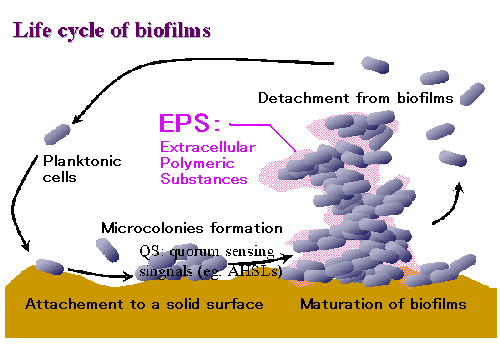
図1.バイオフィルムの形成過程
浮遊細胞が固体表面に付着し、AHSLs やペプチド性の細胞間シグナル分子を介して情報伝達を行いながら高次構造体を形成します.
この際、細胞外には多糖類などの細胞外高分子化合物(EPS)が生産され物理的強度を付与します.
油田から分離した枯草菌野生株 Bacillus subtilis B-1 は強固なバイオフィルムを形成する能力を有します. 最近、トランスポゾン挿入変異法により、バイオフィルムを形成しなくなった変異株を取得しました. その変異遺伝子の解析により、これまで機能未知の膜タンパク質遺伝子とされていた yacD がバイオフィルム形成に関与する遺伝子であることを見出しました. ゲノム解析が終了している実験室株 B. subtilis 168 はバイオフィルムを形成しないので、実験室株だけを用いた研究では yacD の機能解析を行うことは困難でした. このようにバイオフィルムの視点から研究を進めることによって、21世紀の生物学の主要課題のひとつであるポストゲノム解析(機能未知遺伝子の機能解明)にも貢献できると考えられます.[解15]

図2.枯草菌実験室株と野生株の比較[77]
実験室株 168 株は平面なコロニーを形成し、固体表面あるいは界面にバイオフィルムを形成しません.
これに対して油田から分離した野生株 B-1 株は起伏に富んだ立体的なコロニーを形成し、また厚いバイオフィルムを形成します.特に、気液界面に形成される微生物膜はペリクルと呼ばれます.
ペリクルの形成は絶対好気性微生物によく見られます.
この違いは、栄養環境下で継代培養されてきた実験室株は、本来の生き残り戦略が欠落していることを警告するものです.

図3.B-1 株バイオフィルムの電子顕微鏡観察
細胞外に著量の EPS が生産されています.
構造解析の結果、この主成分は納豆のネバネバの成分であるポリ γ-グルタミン酸であることがわかりました.
その生産性とバイオフィルム形成量とは正に相関しています.
一方、環境汚染物質を現場で微生物分解するいわゆるバイオレメディエーション技術(正確にはバイオオーギュメンテーション技術)では、実験室で得られたほどの分解率が得られないことが多いのですが、これは微生物細胞の定着率の低さと細胞活性の低下が原因と考えられます. 私たちは先に述べたフラスコ培養による研究だけではなく、バイオフィルムという視点を取り入れることにより、これらの問題点の解決に役立つ知見が得られるのではないかと考えています.